Fluks magnetic divisualisasikan sebagai sejumlah garis medan magnetic yang memotong
tegak lurus suatu bidang. Fluk magnetic didefinisikan sebagai hasil kali antara komponen


induksi magnetic tegak lurus bidang Β ⊥ dengan luas bidang A.
Φ = Β ⊥ Α = (Β cos θ ) Α
Φ = ΒΑ cos θ
Dengan θ adalah sudut apit terkecil antara arah induksi magnetic B dengan arah
normal bidang n. arah normal bidang adalah arah tegak lurus terhadap bidang.

2. GGL Induksi pada Kawat yang Memotong Medan Magnetik
Pada loop kawat PQRS, yang sebagian berada dalam daerah medan magnetic, sebagian
lainnya berada di luar. Dengan keadaan awal loop diam dan ampere meter menunjuk nol.
Bila loop digerakkan ke kiri, jarum amperemeter menyimpang. Hal ini menunjukkan bahwa
loop PQRS mengalir arus listrik dengan arah yang dilukiskan pada gambar. Arus yang terjadi
dinamakan arus induksi. Arus listrik terjadi karena ada beda potensial antara P dan Q. beda
potensial ini disebut gaya gerak listrik (ggl) induksi.

Cara mudah mengingat arah arus induksi
Kaidah telapak tangan kanan untuk arus induksi :
Buka telapak tangan kanan dengan keempat jari selain jempol dirapatkan. Arahkan
keempat jari sesuai dengan arah induksi magnetic B kemudian putar jempol sehingga
menunjuk sesuai dengan arah kecepatan v, maka arah telapak tangan mendorong
menunjukkan arah induksi dalam kawat/penghantar. (gambar)

Formulasi besar ggl induksi :
Energy permuatan yang dibutuhkan untuk mengalirkan arus dalam loop kawat, yang
disebut gaya gerak listrik.
W/q = ε
Ggl induksi pada ujung-ujung sebuah penghantar yang digerakkan memotong tegak
lurus suatu medan magnetic adalah :
a. Sebanding dengan panjang penghantar l
b. Sebanding dengan besar induksi magnetic B
c. Sebanding dengan kecepatan penghantar digerakkan v
Dengan persamaan :
ε = −lBv
3. Hukum Faraday tentang Induksi Elektromagnetik

Persamaan Faraday atau Hukum Faraday berbunyi sebagai berikut : “ggl induksi yang
timbul pada ujung-ujung suatu penghantar atau kumparan adalah sebanding dengan laju
perubahan fluks magnetic yang dilingkupi oleh loop penghantar atau kumparan tersebut”.
dengan Φ 1 dan Φ 2 berturut-turut adalah fluks magnetic pada keadaan awal dan akhir.
ε = −Ν∆Φ
∆t
Jika perubahan fluks magnetic terjadi dalam selang waktu singkat ( ∆t = 0 ), ggl induksi pada
ujung-ujung kumparan diberikan oleh :
ε = −ΝdΦ
dt
Keterangan :
N = banyak lilitan kumparan
ε = ggl induksi (volt)
∆Φ = perubahan fluks magnetic (Wb)
Tanda negative pada persamaan Faraday berasal dari hukum Lenz.
a. Ggl Induksi oleh Perubahan Luas Bidang Kumparan
Timbulnya ggl induksi akibat perubahan luas bidang kumparan A (B dan θ tetap),
melingkupi fluks magnetic yang telah dibahas.
Persamaan Faraday untuk kasus luas bidang A berubah (B dan θ tetap) adalah
sebagai berikut :
ε = − ΝΒ∆Α
∆t
b. Ggl Induksi oleh Perubahan Besar Induksi Magnetik
Ggl induksi yang ditimbulkan oleh Perubahan Besar Induksi Magnetik adalah
transformator.
Persamaan Faraday untuk kasus besar induksi magnetic B berubah (A dan θ tetap)
adalah sebagai berikut :
ε = − ΝΑ ∆B
∆t
c. Ggl Induksi akibat Perubahan Orientasi Bidang Kumparan

adalah Generator.
Persamaan Faraday untuk kasus orientasi sudut θ berubah (A dan B tetap) adalah
sebagai berikut :
ε = − ΝΒΑ ∆ cos θ
∆t
4. Hukum Lenz tentang Arah Arus Induksi
Dengan menggunakan hukum Faraday, kita dapat menghitung besar ggl induksi pada
ujung-ujung loopatau arus induksi yang mengalir melalui loop. Namun kita tidak dapat
menentukan arah arus induksi melalui loop. Dengan melalui hukum lenz, kita dapat
menentukkan arah arus induksi melalui sebuah loop.

Hukum lenz sebagai berikut :
“Polaritas ggl induksi selalu sedemikian rupa sehingga arus induksi yang ditimbulkannya
selalu menghasilkan fluks induksi yang menentang perubahan fluks utama yang melalui
loop. Ini berarti induksi cenderung mempertahankan fluks utama awal yang melalui
rangkaian.”
5. Induktor

Konsep ggl induksi diri sebuah kumparan

Ggl induksi ε yang dihasilkan dalam kumparan ini sendiri, yang selalu menentang perubahan
fluks utama penyebabnya, disebut ggl induksi diri.

melalui rangkaian? Ggl induksi diri ε sebanding dengan laju perubahan kuat arus terhadap
di
waktu ( dt ), secara matematis :

Dengan L disebut induktansi diri. i 1 dan i 2 adalah kuat arus yang melalui kumparan pada
keadaan awal dan akhir.
Persamaan ini dikemukakan oleh Joseph Henry, sehingga satuan induktansi L dalam SI diberi
nama Henry (disingkat H).
Satuan induktansi diri
Dalam SI satuan ε adalah volt, satuan ∆ i adalah ampere, satuan ∆ t adalah sekon, dan
satuan L adalah henry (H), sehingga diperoleh hubungan satuan:
1Η = 1 VA/ s
Dari hubungan satuan ini , 1 henry didefenisikan sebagai berikut :
Suatu kumparan memiliki induktansi diri 1 henry apabila perubahan kuat arus listrik sebesar
1 ampere dalam 1 sekon pada kumparan tersebut menimbulkan ggl induksi diri sebesar 1
volt.
a. Konsep Induktansi diri sebuah Kumparan
Induktansi diri untuk solenoida atau toroida:
L = µr µ0 Ν 2Α
l
Dengan µ r = permeabilitas relative bahan
N = jumlah lilitan solenoid
A = luas penampang solenoid
Untuk toroida l = 2π r dengan r adalah jari-jari efektif.
b. Energy yang Tersimpan dalam Induktor
Energy dalam inductor (kumparan) tersimpan dalam bentuk medan magnetic.
Persamaan energy inductor sebagai berikut :
W =1 Li2
2
Dengan, L adalah induktansi inductor (henry = H).
6. Latihan soal
1. Tentukan fluks magnetik yang melalui penampang ujung dari sebuah selenoida yang
panjangnya 25 cm, jari-jari 5,0 cm, memiliki 200 lilitan dan mengalirkan arus 5,0 A. (ambil π2
= 9,9 )
2. Sebuah kereta api melaju kearah utara dengan kecepatan 72 km/jam. Jika komponen
vertikal kebawah medan magnetik Bumi adalah 6 x 10-4 T, tentukan besar dan arah ggl
terinduksi pada poros gerbong sepanjang 1,2 m.
3. Sebuah pesawat terbang sedang mengangkasa dengan kecepatan 140 m/s dalam arah
mendatar kebarat. Pada saat itu medan magnetik Bumi dengan besar 5,0 x 10-5 T berarah
30o terhadap arah vertikal. Bila jarak antara ujung-ujung sayap pesawat terbang adalah 24
m, tentukan ggl induksi diantara ujung-ujung sayap.
4. Sebuah kumparan dari 100 lilitan adalah tegak lurus terhadap medan magnetik sehingga
fluks magnetik yang melalui kumparan adalah 200 x 10-6 Wb. Kumparan ditarik secara cepat
sehingga fluks magnetik yang dilingkupi berkurang menjadi nol dalam waktu 0,1 sekon.
Tentukan ggl induksi rata-rata pada kumparan.
5. Sebuah kumparan dengan jari-jari 0,10 m terdiri atas 200 lilitan dan ditempatkan tegak
lurus dalam suatu medan magnetik serba sama 0,2 tesla. Tentukan ggl induksi antara ujung-
ujung kumparan bila dalam 0,1 sekon :
( a ) induksi magnetik menjadi nol,
( b ) medan magnetik dibalik arahnya,
( c ) kumparan diputar 53o.
6. Sebuah kumparan terdiri atas 1000 lilitan pada batang kayu berdiameter 4 cm.
Hambatannya 400 ohm. Kumparan itu dihubungkan dengan galvanot yang hambatan-
hambatannya 228 ohm. Mula-mula kumparan berada dalam medan magnetik B = 0,0115 T
dengan garis medan sejajar batang. Kalau medan itu tiba-tiba ditiadakan, berapakah mutan
yang mengalir pada lewat galvanot ?
7. Sebuah medan magnetik diberikan oleh B(t) = 0,200 t – 0,500 t2 , B dalam T dan t dalam
s, diarahkan tegak lurus pada bidang sebuah kumparan lingkaran dengan jari-jari 2,00 cm,
hambatan total 4,00 Ω dan memiliki 25 lilitan. Tentukan daya disipasi selama 3,00 s.
8. Medan magnetik berarah ke sumbu X, B = BX = -0,2 cos ῳt memot ong sebuah loop datar
dengan luas ( arah normal bidang ) dengan arah sumbu X adalah 60o, tentukan :
( a ) ggl induksi antara ujung-ujung loop,
( b ) arah induksi yang melalui loop.
( Nyatakan jawabanmu dalam ῳ, A, dan R )
9. Suatu kumparan dengan 600 lilitan dan induktansi diri 40 mH mengalami perubahan
arus listrik dari 10 ampere menjadi 4,0 ampere dalam waktu 0,10 sekon. Tentukan beda
potensial antara ujung-ujung kumparan yang ditimbulkannya.
10. Arus yang mengalir dalm kumparan dinyatakan sebagai ὶ = 5 sin 2πt, dengan ὶ dalam A
dan t dalam sekon. Bila induktansi diri kumparan 8 H, tentukan :
( a ) ggl induksi pada t = 1/3 s dan t = 1/6 s
( b ) ggl maksimum










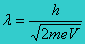













 Hasil pengamatan terhadap gejala efek fotolistrik memunculkan sejumlah fakta yang merupakan karakteristik dari efek fotolistrik. Karakteristik itu adalah sebagai berikut.
Hasil pengamatan terhadap gejala efek fotolistrik memunculkan sejumlah fakta yang merupakan karakteristik dari efek fotolistrik. Karakteristik itu adalah sebagai berikut.















