
1. Postulat Kuantitasi Momentum Sudut Bohr
Louis de Broglie dengan teori gelombang partikelnya menyatakan bahwa partikel (elektron) yang bergerak dengan kecepatan v kemungkinan memiliki sifat gelombang dengan panjang gelombang
Persamaan de Broglie :
Dalam gelombang stationer, frekuensi-frekuensi resonansi tertentu terjadi
jika :
dimana L adalah panjang senar dan r) tepat sama dengan kelipatan bulat positif dari panjang gelombang
Secara matematis ditulis :
Dengan r adalah jari-jari orbit.
Dalam percobaan difraksi elektron, berkas elekron dipercepat oleh tegangan pemercepat V. Misalkan energi yang diberikan tegangan pemercepat V memberikan kecepatan v pada berkas elektron, maka kita dapat menghitung panjang gelombang de Broglie dari elektron dinyatakan dalam tegangan pemercepat V.
Tegangan pemercepat V memberikan energi potensial listrik eV pada elektron.
Energi potensial eV diubah menjadi energi kinetik elektron, sehingga diperoleh hubungan :
Panjang gelombang de Broglie elektron adalah :
Dengan :
h = 6.6 Js
m = massa kg
e = muatan elektron = 1.6 C
V = tegangan pemercepat (volt)
2. Prinsip Ketidakpastian Heisenberg
Prinsip ketidakpastian Heisenberg menyataka bahwa :
tidak mungkin kita mengetahui posisi partikel secara teliti dan momentum partikel secara teliti pada saat yang bersamaan
Bagaimanakah dengan elektron disekitar inti atom? Tentu saja posisi dan momentum elektron tidak dapat detentukan dengan pasti karena elektron selalu bergerak. Akibanya tidak mungkin mengetahui lintasan secara pasti ; yang dapat ditentukan anyalah orbital. Orbital adalah daerah kebolehjadian terbesar untuk menemuka elektron. Tiap titik menunjukan kemungkinan menemukan elektron. Semakin rapat titik, smakin besar peluang menemukan elektron di daerah itu.
3. Bilangan Kuantum
Dalam model atom mekanika kuantum, untuk menetapkan keadaan stationer elektron diperlukan empat bilangan kuantum.
Keempat bilangan kuantum tersebut adalah :
A. bilangan kuantum utama (simbol n)
B. bilangan kuantum orbital (simbol l)
C. bilangan kuantum magnetik (simbol m )
D. bilangan kuantum spin (simbol m )
a. Bilangan Kuantum Utama
Bilangan kuantum utama dalam teori kuantum bersesuaian dengan bilangan kuantum n dalam teori Bohr, yaitu menentukan energi total elektron. Energi total elektron adalah konstan, dapan bernilai apa saja, tetapi harus negatif.
Nilai bilangan kuantum utama adalah bulat mulai dari 1 sampai dengan
Orbit tempat elektron bergerak disebut kulit dan diberi nama dengan huruf besar K, L, M, N, O, … Kulit dengan n = 1 diberi nama kulit K ; kulit dengan n = 2 diberi nama kulit L ; kulit dengan n = 3 diberi nama kulit M ; dan seterusnya.
Nama kulit | K L M N O P … |
Bilangan kuantum utama (n) | 1 2 3 4 5 6 --- |
b. Bilangan Kuantum Orbital
Bilangan kuantum orbital atau sering disebut juga bilangan kuantum azimut, diberi lambang l, adalah bilangan kuantum yang menentukan besar momentum sudut elektron (diberi lambang huruf besar L). Nilai L dibatasi oleh nilai n, yaitu bilangan bulat mulai dari nol sampai dengan (n - 1). Misalnya untuk n = 3, nilai yang diperoleh adalah l = 0, l = 1, dan l = 2.
Menghitung besar momentum sudut (L) dari nilai bilangan kuanum orbital (l) :
Jika bilangan kuantum utama n menyatakan kulit tempat elektron berada, maka bilangan kuantum orbital menyatakan subkulit tempat elektron berada dan juga bentuk orbital. Seperti halnya kulit, subkulit juga diberi nama tetapi dengan manggunakan huruf kecil s, p, d, f, g, h, … Empat huruf pertama berasal dari klasifikasi empiris dari spektrum, yaitu deret sharp (tajam), principal (utama), diffuse (kabur), dan fundamental (pokok).

Dengan demikian, subkulit s untuk l = 0, subkulit p untuk l = 1, subkulit d untuk l = 2, dan seterusnya.
Nama subkulit | s p d f g h … |
Bilangan kuantum orbital | 0 1 2 3 4 5 … |
c. Bilangan Kuantum Magnetik
Untuk menyataka arah momentum sudut diperkenalkan bilangan kuantum magnetik, diberi lambang m . Nilai m dibatasi oleh nilai l, yaitu bilangan bulat mulai dari –l sampai dengan +l.
Banyaknya nilai m yang diperbolehkan :
banyak m = 2l + 1
Misalanya :
untuk l = 0, banyak m adalah 2(0) + 1 = 1
untuk l = 1, banyak m adalah 2(1) + 1 = 3
untuk l = 2, banyak m adalah 2(2) + 1 = 5
Banyak m juga menyatakan banyak orbital yang dimiliki oleh sebuah subkulit. Misalnya :
subkulit s (l = 0) memiliki satu m berarti memiliki 1 orbital
subkulit s (l = 1) memiliki satu m berarti memiliki 3 orbital
subkulit s (l = 2) memiliki satu m berarti memiliki 5 orbital
Bagaimanakah kaitan antara m dengan arah momentum sudut orbital? Misalkan medan , adalah terkuantitasi. Nilai-nilai L yang diperbolehkan berkaitan dengan nilai m , dinyatakan
oleh :
Fakta bahwa arah L dikuantitasi dengan acuan ke medan
d. Bilangan Kuantum Spin
Momentum sudut spin hanya dapat memiliki dua orientasi atau dua arah, ditentukan oleh bilangan kuantum magnetik spin atau sering hanya disebut bilangan kuantum spin, diberi lambang m , dimana m hanya diperbolehkan memiliki dua nilai : + dan - .
Komponen Z (searah medan diberikan oleh :
Nilai m = + menunjukkan arah spin ke atas (putaran elektron terhadap porosnya berlawanan arah jarum jam), sedangkan nilai m = - menunjukkan arah spin ke bawah (putaran elektron terhadap porosnya searah jarum jam).
RANGKUMAN KEEMPAT BILANGAN KUANTUM
lihat gambar berikut

Nama | Notasi | Nilai-nilai yang diperbolehkan |
Bilangan kuantum utama Bilangan kuantum orbital Bilangan kuantum magnetik Bilangan kuantum spin | n l m m | 1, 2, 3, … 0, 1, 2, … (n - 1) -l, …, -2, -1, 0, + 1, + 2. …, + l - |
4. Asas Larangan Pauli
Asas larangan Pauli
Tidak ada dua elektron dalam sebuah atom yang dapat memiliki keempat bilangan kuantum yang persis sama.
Asas ini menyatakan bahwa tidak ada dua elektron dalam sebuah atom dapat memiliki sekumpulan bilangan kuantum (n, l, m , m ) yang persis sama. Kedua elektron bisa saja memiliki tiga bilangan kuantum yang tepat sama tetapi satu bilangan kuantum yang lainnya haruslah berbeda.
Asas larangan Pauli juga membatasi setiap orbital hanya mampu menampung maksimum 2 elektron, dan dalam satu orbital (elektron berpasangan) harus memiliki spin dengan arah yang berlawanan.

Berdasarkan asas larangan Pauli maka satu orbital maksimm ditempati dua elektron. Kedua elektron ini harus memiliki spin yang berlawanan.

Soal-soal:
- Sebuah electron dipercepat pada beda potensial 36 kV dalam suatu tabung hampa udara.
a). Tentukan panjang gelombang minimum electron.
b). Jika beda potensial ditingkatkan menjadi 64 kV, berapakah panjang gelombang minimum electron sekarang?
h=6,6 * 10 pangkat -34J s; me=9 * 10 pangkat -31 kg)
- Sebuah electron bebas memiliki fungsi gelombang y(x) = A sin ( 5 x 10 pangkat 10 x); x dalam meter. Tentukan:
a). Panjang gelombang de Broglie electron;
b). Momentum electron;
c). energi electron dalam eV.
3. Tentukan energi electron pada keadaan n= 1, 2, dan 3 untuk ion-ion:
a). Li 2+ (Z=3)
b). Be 3+ (Z=4)
c). C 5+ (Z=6).
4. Tentukanlah bilangan kuantum utama dari orbit-orbit berikut ini:
a). Orbit electron pada atom hydrogen dengan energi -0,544 eV.
b). Orbit electron pada ion He+ dengan energi -3,4 eV.
c). Orbit electron pada ion Li 2+ dengan energi -4,90 eV.
5. Hitung harga ml dalam subkulit-subkulit berikut:
a). 2s c). 5f
b). 3d d). 4p
6. Jika harga n untuk suatu electron adalah 6, tentukan subkulit yang diperbolehkan untuk electron ini!.
7. Sebuah electron berada pada keadaan 4d.
a). Berapakah bilangan kuantum utamanya?
b). Berapakah bilangan kuantum orbitalnya?
c). Berapakah besar momentum sudut electron?
8. Ulangi pertanyaan seperti nomor 7 untuk elaktron yang berada pada keadaan:
a). 5f c). 6h
b). 6g
9. a). Berapakah nilai-nilai l yang diperbolehkan bagi n = 5?
b). Berapakah nilai-nilai ml yang diperbolehkan bagi l = 5?
c). Berapakah nilai n terkecil yang paling mungkin agar l = 5?
d). Berapakah nilai n terkecil yang paling mungkin agar komponen Z dari momentum sudut orbital sama dengan 4h?
10. Berapa benyak orbital yang terdapat dalam kulit dengan n= 6?







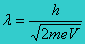









0 comments:
Post a Comment